【中国发明,中国发明授权】一种用于雄激素受体转录后修饰位点预测的体外迷你报告基因及应用
无权-未缴年费 中国
- 申请号:
- CN201510004999.1
- 专利权人:
- 上海市同济医院
- 授权公告日/公开日:
- 2017.06.06
- 专利有效期:
- 2015.01.04-2035.01.04
- 技术分类:
- C12:生物化学,啤酒,烈性酒,果汁酒,醋
- 转化方式:
- 转让
- 价值度指数:
-
- 54.0分
- 价格:
- 面议
- 专利信息&法律状态
- 专利自评
- 专利技术文档
- 价值度指数
- 发明人阵容
 著录项
著录项
- 申请号
- CN201510004999.1
- 申请日
- 20150104
- 公开/公告号
- CN104593360A
- 公开/公告日
- 20150506
- 申请/专利权人
- [上海市同济医院]
- 发明/设计人
- [张子强, Y·莫, 邱忠民, 朱竹先, 吕寒静]
- 主分类号
- C12N15/11
- IPC分类号
- C12N 9/0008(2013.01) C12N 9/16
- CPC分类号
- C12N 9/0008(2013.01) C12N 9/16(2013.01)
- 分案申请地址
- 国省代码
- 上海(31)
- 颁证日
- G06T1/00
- 代理人
- [金重庆]
 摘要
摘要
本发明涉及一种用于雄激素受体转录后修饰位点预测的体外迷你报告基因及应用。实验表明,lncRNAPCGEM1通过调控雄激素受体异构体AR-V7(AR3)pre-mRNA的转录后修饰,直接决定了表达雄激素受体的肿瘤的激素去势治疗后去势抵抗或复发转移;在此基础上,选取AR的pre-mRNA的包含外显子Exon3和Exon4之间序列,通过基因克隆构建迷你报告基因;一方面,该迷你报告基因用于预测前列腺癌等雄激素受体相关肿瘤的激素去势复发及转移的高度危险因子;另一方面,通过该迷你报告基因,可以能够直观和高效、准确的验证和阻断该特异性目标基因位点的表达及作用。
 法律状态
法律状态
| 法律状态公告日 | 20221213 |
| 法律状态 | 专利权的终止 |
| 法律状态信息 | 未缴年费专利权终止 IPC(主分类):C12N 15/11 专利号:ZL2015100049991 申请日:20150104 授权公告日:20170606 终止日期:20220104 |
| 法律状态公告日 | 20170606 |
| 法律状态 | 授权 |
| 法律状态信息 | 授权 |
| 法律状态公告日 | 20150527 |
| 法律状态 | 实质审查的生效 |
| 法律状态信息 | 实质审查的生效 IPC(主分类):C12N 15/11 申请日:20150104 |
| 法律状态公告日 | 20150506 |
| 法律状态 | 公开 |
| 法律状态信息 | 公开 |
 权利要求
权利要求
权利要求数量(8)
独立权利要求数量(4)
1.一种用于雄激素受体转录后修饰位点预测的AR3迷你报告基因,其特 征在于,包含序列如SEQ ID NO.13所示的核苷酸序列。
2.根据权利要求1所述的AR3迷你报告基因,其特征在于,所述AR3迷 你报告基因通过下述方法克隆构建组成:
a)通过PCR法,以SEQ ID NO.1及SEQ ID NO.3所示的序列作为引物, 以人类基因组DNA为模板扩增AR的外显子exon3和部分内含子序列(长 2.3kb);
b)通过PCR法,以SEQ ID NO.2及SEQ ID NO.5所示的序列作为引物, 以人类基因组DNA为模板扩增AR的内含子加上部分外显子exon3b序列 (E3b,序列长1kb);
c)以SEQ ID NO.4及SEQ ID NO.6所示的序列作为引物,应用PCR法扩 增mCherry;
d)将a)、b)和c)扩增产物通过常规方法顺序连接克隆进pCDH-Pu载 体(SBI),插入位点为EcoR I和Not I酶切位点。
3.权利要求1所述的AR3迷你报告基因在制备药物中的应用。
4.权利要求1所述的AR3迷你报告基因在制备治疗癌症药物中的应用。
5.根据权利要求4所述的应用,其特征在于,所述的癌症是实体瘤,或所 述的癌症细胞来源于实体瘤。
6.根据权利要求4所述的应用,其特征在于,所述的癌症为前列腺癌、肺 癌、乳腺癌、睾丸癌、子宫颈癌或结肠癌。
7.权利要求1所述的AR3迷你报告基因在制备诊断AR相关肿瘤的去势 抵抗及复发的试剂中的应用。
8.一种用于检测和定量细胞中的AR3表达的试剂盒,其特征在于,包含:
a)权利要求1所述的AR3迷你报告基因;
b)适合重配a)的盐水或缓冲溶液。
1.一种用于雄激素受体转录后修饰位点预测的AR3迷你报告基因,其特征在于,包含序列如SEQ ID NO.13所示的核苷酸序列。
2.根据权利要求1所述的AR3迷你报告基因,其特征在于,所述AR3迷你报告基因通过下述方法克隆构建组成:
a)通过PCR法,以SEQ ID NO.1及SEQ ID NO.3所示的序列作为引物,以人类基因组DNA为模板扩增AR的外显子exon3和部分内含子序列(长2.3kb);
b)通过PCR法,以SEQ ID NO.2及SEQ ID NO.5所示的序列作为引物,以人类基因组DNA为模板扩增AR的内含子加上部分外显子exon3b序列(E3b,序列长1kb);
c)以SEQ ID NO.4及SEQ ID NO.6所示的序列作为引物,应用PCR法扩增mCherry;
d)将a)、b)和c)扩增产物通过常规方法顺序连接克隆进pCDH-Pu载体(SBI),插入位点为EcoR I和Not I酶切位点。
3.权利要求1所述的AR3迷你报告基因在制备药物中的应用。
4.权利要求1所述的AR3迷你报告基因在制备治疗癌症药物中的应用。
5.根据权利要求4所述的应用,其特征在于,所述的癌症是实体瘤,或所述的癌症细胞来源于实体瘤。
6.根据权利要求4所述的应用,其特征在于,所述的癌症为前列腺癌、肺癌、乳腺癌、睾丸癌、子宫颈癌或结肠癌。
7.权利要求1所述的AR3迷你报告基因在制备诊断AR相关肿瘤的去势抵抗及复发的试剂中的应用。
8.一种用于检测和定量细胞中的AR3表达的试剂盒,其特征在于,包含:
a)权利要求1所述的AR3迷你报告基因;
b)适合重配a)的盐水或缓冲溶液。
 说明书
说明书
技术领域
本发明涉及分子生物学技术领域,具体地说,是一种用于雄激素受体转录后修饰位点预测的体外迷你报告基因及应用。
背景技术
癌症占人类死亡病因的近1/4。在过去的几十年里肿瘤复发和转移仍是改善整体存活率的主要障碍,这可能主要归因于人们对于癌症生物学仍然缺乏全面的了解。例如,功能基因组学研究的最新进展表明,参与人类基因转录的绝大多数是非编码RNA包括长链非编码RNA(lncRNAs)。然而,对于lncRNAs在调控癌症基因表达及机制等方面人类仍然所知甚少[1]。
近期我们通过对肿瘤表观遗传机制的研究发现lncRNAs可以通过多种机制调控肿瘤的进展。新近有研究表明lncRNAPCGEM1可以与雄激素受体(AR)结合作用[2]。PCGEM1在前列腺癌上调[3],可促进细胞增殖[4],而我们则通过临床标本研究发现,PCGEM1以及PCAT1的基因表达与前列腺癌恶性程度及转移复发呈高度相关性,PCGEM1不但可以通过与AR直接作用,更重要的是PCGEM1与AR异构体,如AR-V7(AR3)的表达呈高度正相关,我们进一步证明了PCGEM1通过选择性转录修饰调控了AR的异构体如AR3的表达。由此发现lncRNAs如PCGEM1可能通过调控AR基因转录的表观遗传机制参与AR相关肿瘤的增殖、恶性侵袭复发及转移驱动。因为在一定程度上是由于AR的异构体如AR3介导了该类肿瘤的激素去势抵抗,而并非野生型全长AR。而研究已表明AR3在AR在很大程度上诱导形成了相关肿瘤如前列腺癌的激素去势抵抗[5]。
针对上述AR相关肿瘤的特异性调节lncRNAPCGEM1显著参与调控了与该类肿瘤的激素去势抵抗相关AR异构体(如AR3)的表达。本发明是建立在研究所表明的lncRNAPCGEM1或hnRNPA1和U2AF65参与调控的表观遗传机制的基础上,即lncRNAsPCGEM1通过调控雄激素受体异构体AR3pre-mRNA的转录后修饰及共定位,直接决定了表达雄激素受体的肿瘤如前列腺癌、肺癌及乳腺癌等的激素去势治疗后去势抵抗或复发转移。
本发明涉及的迷你报告基因质粒主要是建立在表观遗传机制调控的基础上,如lncRNAPCGEM1通过调控雄激素受体异构体AR3pre-mRNA的转录后修饰,直接决定了表达雄激素受体的肿瘤如前列腺癌、肺癌及乳腺癌等的激素去势治疗后去势抵抗或复发转移。应用该迷你报告基因,可以验证lncRNAPCGEM1或hnRNPA1,U2AF65等转录修饰剪切因子的作用机制。上述调节因子可以通过该迷你报告基因上表现出经基因转录后修饰机制对雄激素受体(AR)异构体产生的调控作用。一方面,该迷你报告基因用于预测前列腺癌等雄激素受体相关肿瘤的激素去势复发及转移的高度危险因子;另一方面,通过该迷你报告基因,可以能够直观和高效、准确的验证和阻断该特异性目标基因位点的表达及作用。最终服务于临床雄激素受体相关肿瘤的激素去势治疗后复发及转移的靶向治疗。为临床有效靶向阻断PCGEM1所介导的雄激素受体异构体AR3,可以有效的降低雄激素受体(AR)相关肿瘤的激素去势治疗后的去势抵抗和复发转移情况。本发明的AR3迷你报告基因及试剂盒是基于当前最新的研究结果而建立。这是一种目前其他方法都无法替代的技术方法,迄今为止尚未见相关报道。
参考文献:1.Xie C,Yuan J,Li H,Li M,Zhao G,Bu D,et al.NONCODEv4:exploring the world of long non-coding RNA genes.Nucleic acids research.2013;doi:10.1093/nar/gkt1222.
2.Yang L,Lin C,Jin C,Yang JC,Tanasa B,Li W,et al.lncRNA-dependentmechanisms of androgen-receptor-regulated gene activation programs.Nature.2013;29:598-602.
3.Srikantan V,Zou Z,Petrovics G,Xu L,Augustus M,Davis L,et al.PCGEM1,a prostate-specific gene,is overexpressed in prostate cancer.Proceedings of theNationalAcademy ofSciences ofthe United States ofAmerica.2000;97:12216-21.
4.Petrovics G,Zhang W,Makarem M,Street JP,Connelly R,Sun L,et al.Elevated expression of PCGEM1,a prostate-specific gene with cellgrowth-promoting function,is associated with high-risk prostate cancer patients.Oncogene.2004;23:605-11.
5.Antonarakis ES,et al.AR-V7and resistance to enzalutamide and abirateronein prostate cancer.The New Englandjournal ofmedicine.2014;371,1028-1038.
发明内容
本发明的目的是针对现有技术中的不足,提供一种用于雄激素受体转录后修饰位点预测的AR3迷你报告基因。
本发明的再一的目的是,提供所述迷你报告基因的用途。
本发明的另一的目的是,提供一种用于检测和定量细胞中的AR3表达的试剂盒。
为实现上述目的,本发明采取的技术方案是:
一种用于雄激素受体转录后修饰位点预测的AR3迷你报告基因,包含序列如SEQ ID NO.13所示的核苷酸序列。
所述AR3迷你报告基因通过下述方法克隆构建组成:
a)通过PCR法,以SEQ ID NO.1及SEQ ID NO.3所示的序列作为引物,以人类基因组DNA为模板扩增AR的外显子exon3和部分内含子序列(长2.3kb);
b)通过PCR法,以SEQ ID NO.2及SEQ ID NO.5所示的序列作为引物,以人类基因组DNA为模板扩增AR的内含子加上部分外显子exon3b序列(E3b,序列长1kb);
c)以SEQ ID NO.4及SEQ ID NO.6所示的序列作为引物,应用PCR法扩增mCherry;
d)将a)、b)和c)扩增产物通过常规方法顺序连接克隆进pCDH-Pu载体(SBI),插入位点为EcoR I和Not I酶切位点。
为实现上述第二个目的,本发明采取的技术方案是:
所述的AR3迷你报告基因在制备药物中的应用。
所述的AR3迷你报告基因在制备治疗癌症药物中的应用。
所述的癌症是实体瘤,或所述的癌症细胞来源于实体瘤。
所述的癌症为前列腺癌、肺癌、乳腺癌、睾丸癌、子宫颈癌或结肠癌。
为实现上述第三个目的,本发明采取的技术方案是:
一种用于检测和定量细胞中的AR3表达的试剂盒,包含:
a)上述的AR3迷你报告基因;
b)适合重配a)的盐水或缓冲溶液。
本发明目的是提供一种用于雄激素受体(AR)转录后修饰位点预测的体外迷你报告基因及其应用。
所述迷你报告基因用于诊断AR相关肿瘤的激素去势复发、转移及其他相关肿瘤,用于协助靶向治疗AR相关肿瘤疾病。
所述迷你报告基因克隆构建引物如下所示:
pCDH-Myc-R1-AR3-E3-5.1(SEQ ID NO.1):
CCATGGAGGCCCGAATTCTGGGGAAACAGAAGTACCTGTGC
AR-I3-5.2+I3-3.1-R(SEQ ID NO.2):
CTGGGTGGCTGCGTGTTTTTTAAACTAGATCTGCCTGACT
AR-I3-5.2+I3-3.1-F(SEQ ID NO.3):
AGTCAGGCAGATCTAGTTTAAAAAACACGCAGCCACCCAG
AR3-mC-5.1(SEQ ID NO.4):
TGACTTGCCTCATTCAAAAGTGGTGAGCAAGGGCGAGGAG
AR3-mC-3.1(SEQ ID NO.5):
CTCCTCGCCCTTGCTCACCACTTTTGAATGAGGCAAGTCA
mC-pCDH-Sal1-3.1(SEQ ID NO.6):
TCCAGAGGTTGATTGTCGACTTACAGCTCGTCCATGCCGC
所克隆AR3迷你报告基因为一段长约3.3kb的AR的pre-mRNA序列(包括内含子),所克隆的AR3迷你报告基因经基因转录剪切修饰后的序列如SEQID NO.13所示。
通过本发明的迷你报告基因,验证PCGEM1所介导的雄激素受体异构体AR3,可以有效的降低雄激素受体(AR)相关肿瘤的激素去势治疗后的去势抵抗和复发转移情况。上述方法具有高效及灵敏和特异性强的优点,具有切实的潜在临床使用价值。
本发明方法优选地用于体外预测和验证治疗或预防癌症靶点,尤其是用于治疗可能发生在下述组织中的癌症,如肺癌、乳腺癌、结肠癌、前列腺癌、胰腺癌、肝癌、甲状腺癌、肾癌、脑癌、睾丸癌、胃癌、肠癌、脊髓癌、窦癌、膀胱癌、泌尿道癌或卵巢癌。
本发明也提供了治疗癌症的方法的验证和评价,换而言之,本发明另外涉及治疗癌症方法的探索。
本发明可以用作研究试剂,用于诊断、预防和治疗。在研究中,该迷你报告基因可用于对靶基因的功能性分析,或评价其作为治疗干预目标的有效性。在诊断中,该迷你报告基因可用于检测和定量细胞中的AR-V7(AR3)表达,通过RNA印迹、原味杂交货类似的技术来实现。
不限于本发明所述的迷你报告基因,使用该报告基因定义的缀合物或该报告基因组成的药物组合物都在本发明的保护范围内。
本发明优点在于:通过实验表明,lncRNAPCGEM1通过调控雄激素受体异构体AR-V7(AR3)pre-mRNA的转录后修饰,直接决定了表达雄激素受体的肿瘤如前列腺癌、肺癌及乳腺癌等的激素去势治疗后去势抵抗或复发转移,在此基础上,选取雄激素受体(AR)的pre-mRNA的外显子Exon3和Exon4之间序列(包含基因转录后剪切修饰前的内含子序列),通过基因克隆构建迷你报告基因;一方面,该迷你报告基因用于预测前列腺癌等雄激素受体相关肿瘤的激素去势复发及转移的高度危险因子;另一方面,通过该迷你报告基因,可以能够直观和高效、准确的验证和阻断该特异性目标基因位点的表达及作用。
注:本发明中“AR”表示雄激素受体,“AR3”为“AR”的同构体;“lncRNA”表示长链非编码RNA。
附图说明
附图1是克隆构建迷你报告基因。
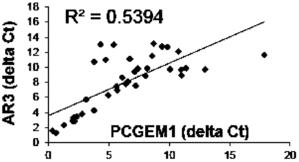
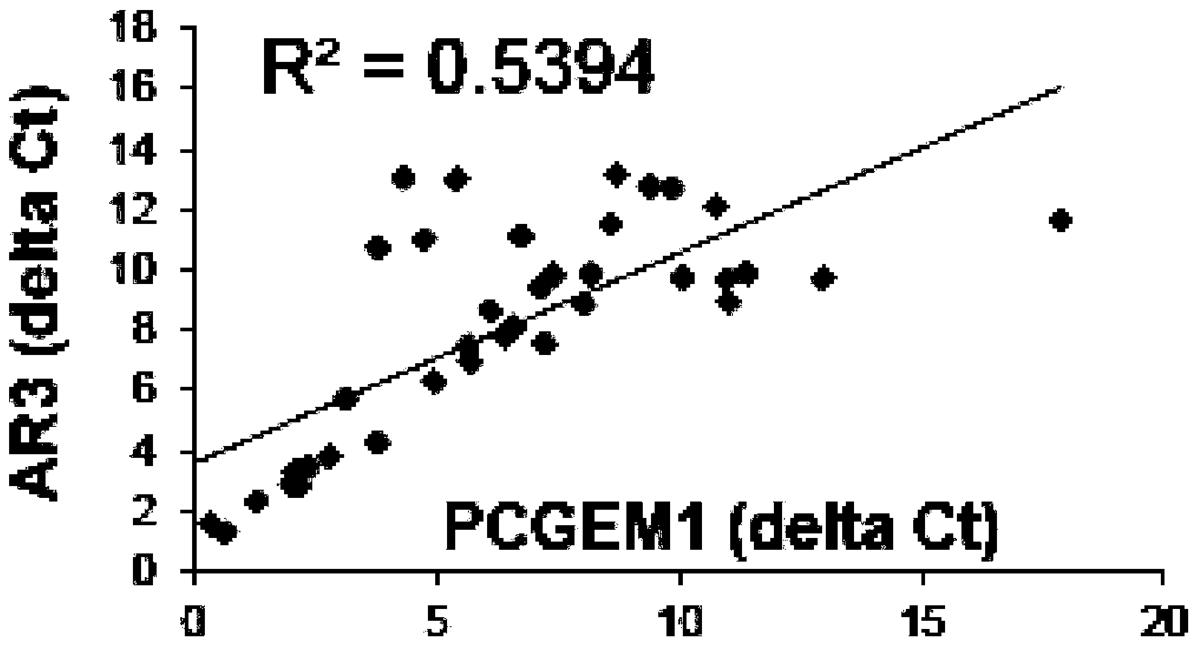
附图2是实施例2定量PCR检测结果。瘤组织中PCGEM1和AR-V7(AR3)的高表达,且二者具有显著相关性。
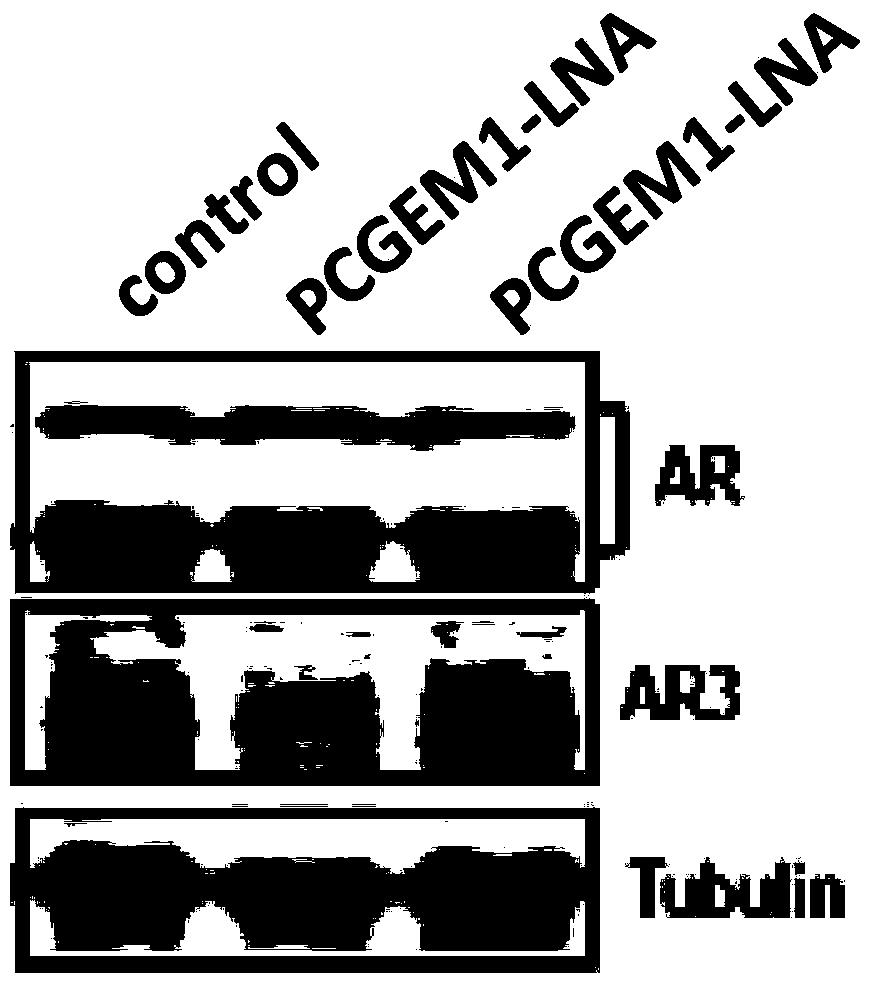
附图3是PCGEM1参与调控AR3表达。
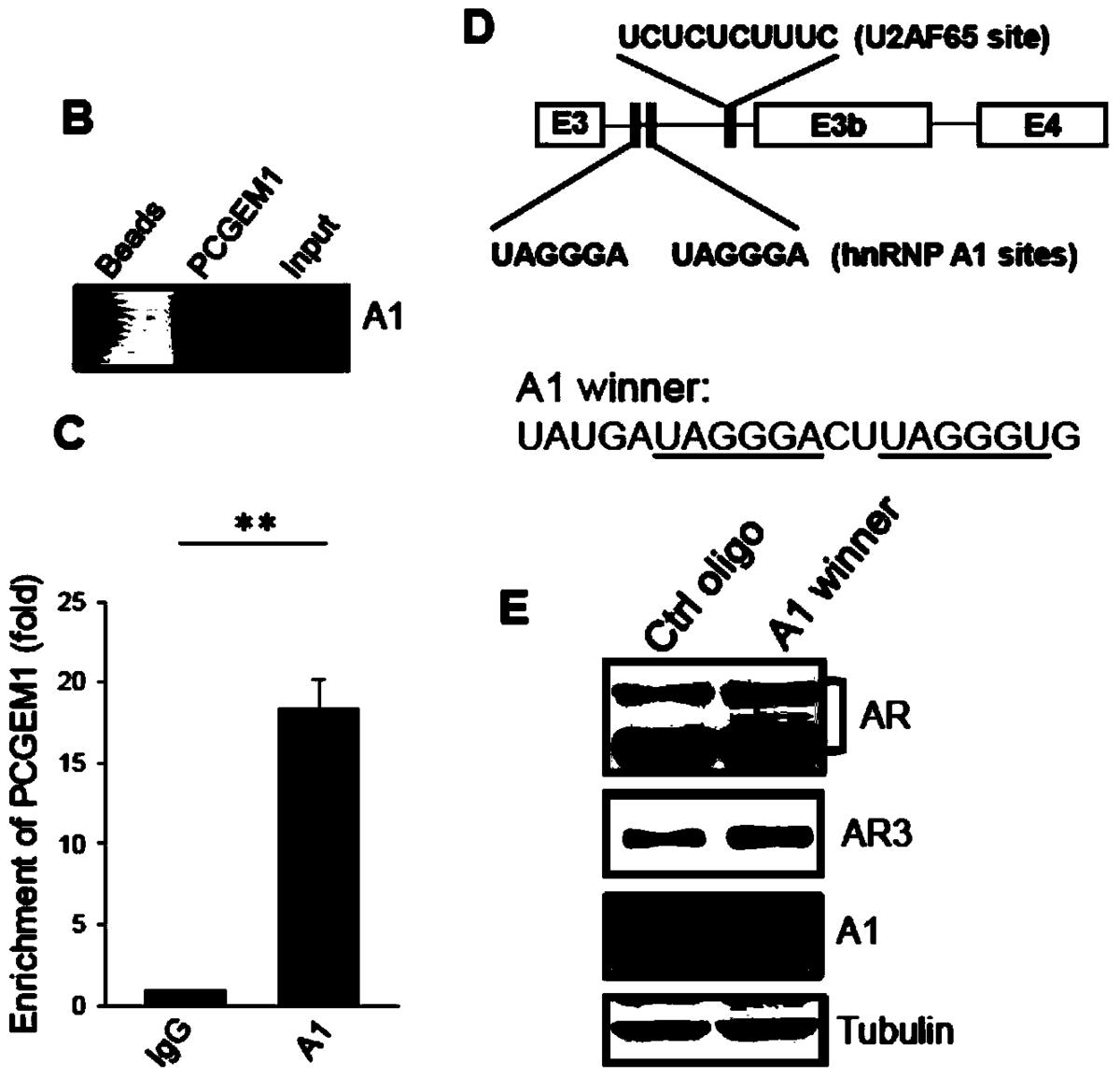
附图4是检验PCGEM1通过调节转录修饰因子hnRNPA1调控AR3的表达。迷你报告基因中的hnRNPA1、U2AF65的基因位点,及hnRNPA1、U2AF65参与了AR的基因转录后剪切修饰。
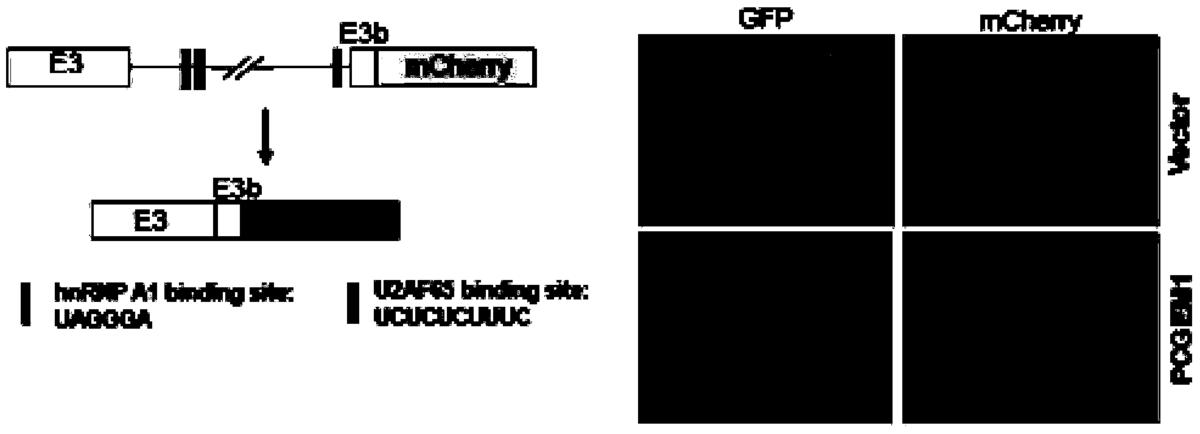
附图5是验证AR3迷你报告基因。通过该迷你报告基因,显示PCGEM1参与的AR的基因转录后剪切修饰,表明了迷你报告基因中的转录修饰因子hnRNPA1等基因位点,及hnRNPA1参与AR的基因转录后剪切修饰。
具体实施方式
本发明涉及一种一种用于雄激素受体(AR)转录后修饰位点预测的体外迷你(迷你)报告基因及应用。该体外迷你报告基因是选取雄激素受体(AR)的pre-mRNA的外显子Exon3和Exon4之间序列(包含基因转录后剪切修饰前的内含子序列),通过基因克隆构建而形成。该迷你报告基因以质粒形式存在,其克隆构建所需引物的序列如图1。该迷你报告基因质粒的克隆构建主要是建立在表观遗传机制调控的基础上,如lncRNAPCGEM1通过调控雄激素受体异构体AR-V7(AR3)pre-mRNA的转录后修饰,直接决定了表达雄激素受体的肿瘤如前列腺癌、肺癌及乳腺癌等的激素去势治疗后去势抵抗或复发转移。应用该迷你报告基因,可以验证lncRNAPCGEM1或hnRNPA1,U2AF65等转录修饰剪切因子的作用机制。上述调节因子可以通过该迷你报告基因上表现出经基因转录后修饰机制对雄激素受体(AR)异构体产生的调控作用。一方面,该迷你报告基因用于预测前列腺癌等雄激素受体相关肿瘤的激素去势复发及转移的高度危险因子;另一方面,通过该迷你报告基因,可以能够直观和高效、准确的验证和阻断该特异性目标基因位点的表达及作用。最终服务于临床雄激素受体相关肿瘤的激素去势治疗后复发及转移的靶向治疗。
下面结合附图对本发明提供的具体实施方式作详细说明。
实施例1
AR3迷你报告基因质粒(图1),其由下述的引物序列克隆组成:
pCDH-Myc-R1-AR3-E3-5.1(SEQ ID NO.1):
CCATGGAGGCCCGAATTCTGGGGAAACAGAAGTACCTGTGC
AR-I3-5.2+I3-3.1-R(SEQ ID NO.2):
CTGGGTGGCTGCGTGTTTTTTAAACTAGATCTGCCTGACT
AR-I3-5.2+I3-3.1-F(SEQ ID NO.3):
AGTCAGGCAGATCTAGTTTAAAAAACACGCAGCCACCCAG
AR3-mC-5.1(SEQ ID NO.4):
TGACTTGCCTCATTCAAAAGTGGTGAGCAAGGGCGAGGAG
AR3-mC-3.1(SEQ ID NO.5):
CTCCTCGCCCTTGCTCACCACTTTTGAATGAGGCAAGTCA
mC-pCDH-Sal1-3.1(SEQ ID NO.6):
TCCAGAGGTTGATTGTCGACTTACAGCTCGTCCATGCCGC
雄激素受体(AR)的异构体AR3迷你报告基因(AR3mini gene cassettemCherry reporter)根据如下方法构建:
应用PCR方法,以人类基因组DNA为模板扩增AR的外显子exon3(E3)和部分内含子(长约2.3kb)序列,该过程用到的引物为pCDH-Myc-R1-AR3-E3-5.1(SEQ ID NO.1)和AR-I3-5.2+I3-3.1-F(SEQ ID NO.3)。同样以人类基因组为模板扩增AR的内含子加上上部分外显子exon3b(E3b,序列长约1kb)序列,该过程所用的引物为AR-I3-5.2+I3-3.1-R(SEQ ID NO.2)和AR3-mC-3.1(SEQ ID NO.5)。另外,应用PCR方法扩增mCherry,该过程应用到的引物为AR3-mC-5.1(SEQ ID NO.4)和mC-pCDH-Sal1-3.1(SEQ ID NO.6)。上述三段序列被同时克隆进pCDH-Pu(SBI)载体,其插入位点为EcoR I和NotI酶切位点,所克隆AR3迷你报告基因为一段长约3.3kb的AR的pre-mRNA序列(SEQ ID NO.13)。上述克隆所用到的试剂为Cold Fusion试剂盒。具体实验克隆方法及步骤参照“Sachdeva,M.,et al.p53represses c-Myc through induction ofthe tumor suppressor miR-145.Proceedings ofthe National Academy of Sciences ofthe United States ofAmerica 106,3207-3212(2009)”。
实施例2实时定量PCR检测PCGEM1及AR3的表达量(图2)
靶基因的表达水平可使用例如:定量PCR、核糖核酸酶保护测试按常规确定。为实例提供以下细胞类型,但是其他细胞类型也可按常规使用,条件是靶物在所选细胞类型中表达。
LNCaP细胞培养在如以下所述的合适培养基中,并保持在37℃、95-98%湿度和5%CO2中。当在低氧或缺氧下培养时,O2水平分别保持在1-2%或0-0.5%。细胞每周按常规传代2-3次。
(1)收集细胞。
(2)提取细胞中的总RNA。采用Ambion公司的RNA提取试剂盒(AM1560),按照试剂盒说明书方法进行操作。
(3)取100ng的总RNA,逆转录。
(4)取第一步反转得到的产物,根据Ambion公司的试剂盒说明书进行后续的real-time实验。
实时定量PCR引物序列如下,
PCGEM1:5.1-TTTTTGCCCTATGCCGTAAC(SEQ ID NO.7),
3.1-GGAGACTCCCAACCTGATGA(SEQ ID NO.8)。
AR3:5.1-GCAATTGCAAGCATCTCAAA(SEQ ID NO.9),
3.1-GGAGGGAGTCAGCAATCAAG(SEQ ID NO.10)。
(5)RT-PCR试剂盒完成逆转录(Takara)。
(6)荧光定量PCR试剂盒检测(Takara)。
(7)数据及结果分析及相关性分析。
实验结果如图2所示,从图中可以看出,肿瘤组织中PCGEM1和AR-V7(AR3)的高表达,且二者具有显著相关性。
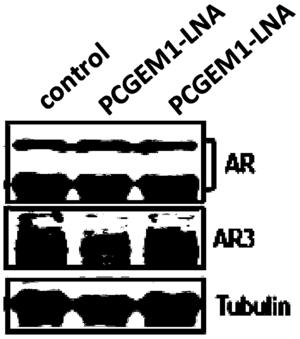
实施例3PCGEM1参与调控的AR3转录后修饰表达(图3)
(1)LNCaP细胞,用1640培养基加10%FBS培养至细胞密度达50%。
(2)用RNA转染试剂,按照说明书的常规操作方式转染PCGEM1-LNA和NC,终浓度达50nM。其中,PCGEM1-LNA序列为A+T+T+CCCCTCAGA+A+ATCTCAGGGCTT+G+T+C,其中+选自β-D-氧-LNA核苷酸类似物中的任一种。转染PCGEM1-LNA目的是通过下调PCGEM1表达,观察对AR3表达的影响。
(3)转染时间到12小时之后,换上新鲜的培养基,继续培养24小时。
(4)吸去培养基,收集细胞后提取总RNA,通过norhtern检测PCGEM1调控的AR3表达量,具体操作方法参见“Zhang Z,Zhu Z,Watabe K,Zhang X,Bai C,Xu M,Wu F,Mo YY.Negative regulation of lncRNA GAS5by miR-21.Cell DeathDiffer.2013”。
实验结果如图3所示,通过分析可知,PCGEM1参与调控AR3的表达。
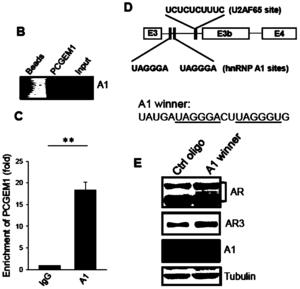
实施例4检验PCGEM1通过调节转录修饰因子hnRNPA1调控AR3的表达(图4)
通过RNA-pulldown方法,检测PCGEM1通过结合并调节hnRNPA1影响AR3的基因转录后修饰剂表达。所应用的T7-PCGEM1核酸探针序列为:
T7-PCGEM1-5.1(SEQ ID NO.11):
TAATACGACTCACTATAGGGAGGCACTCTGGCACCCAGTT,
pCGEM1-Not1-3.1(SEQ ID NO.12):
GCGGCCGCGAAATCTTTAATATTTGTTA,具体操作方法参见“Zhang Z,Zhu Z,Watabe K,Zhang X,Bai C,Xu M,Wu F,Mo YY.Negative regulation oflncRNAGAS5by miR-21.Cell Death Differ.2013”。另外,应用hnRNPA1的winner竞争性靶向hnRNPA1可以促进AR3的表达,进一步证明了调节基因转录后修饰因子如hnRNPA1可以调控AR3的表达;具体应用LNCaP细胞,并进行体外细胞转染。
细胞培养在如以下所述的合适培养基中,并保持在37℃、95-98%湿度和5%CO2中。当在低氧或缺氧下培养时,O2水平分别保持在1-2%或0-0.5%。细胞每周按常规传代2-3次。LNCap:人前列腺癌细胞系LNCap购自ATCC,并维持在含有Glutamax+10%FBS的RPMI中。
结果见图4,从图4中可以看出,迷你报告基因中的hnRNPA1、U2AF65的基因位点,及hnRNPA1、U2AF65参与了AR的基因转录后剪切修饰。
实施例5验证AR3迷你报告基因(图5)
应用LNCaP细胞,用1640培养基加10%FBS培养至细胞密度达50%。通过DNA转染试剂(Lipo2000,Invitrogen),按照说明书的常规操作方式转染PCGEM1和AR3迷你报告基因质粒(1:1比例),其中AR3迷你报告基因质粒对照组为PCGEM1和空白质粒,终浓度达50nM。转染时间到12小时之后,换上新鲜的培养基,继续培养24小时,通过荧光显微镜开始动态观测PCGEM1参与调控的AR3基因的基因转录修饰和产生(mCherry红色荧光信号的产生表示AR3基因的剪切后生)。具体细胞转染操作步骤参照实施例3。
结果见图5,通过该迷你报告基因,显示PCGEM1参与的AR的基因转录后剪切修饰,表明了迷你报告基因中的转录修饰因子hnRNPA1等基因位点,及PCGEM1调节hnRNPA1参与的AR的基因转录后剪切修饰。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
 价值度评估
价值度评估
技术价值
经济价值
法律价值
0 0 054.0分
0 50 75 100专利价值度是通过科学的评估模
型对专利价值进行量化的结果,
基于专利大数据针对专利总体特
征指标利用计算机自动化技术对
待评估专利进行高效、智能化的
分析,从技术、经济和法律价值
三个层面构建专利价值评估体
系,可以有效提升专利价值评估
的质量和效率。
总评:54.0分
该专利价值中等 (仅供参考)
本专利文献中包含【5 个实施例】、【4 个技术分类】,从一定程度上而言上述指标的数值越大可以反映出所述专利的技术保护及应用范围越广。 【专利权的维持时间7 年】专利权的维持时间越长,其价值对于权利人而言越高。
技术价值 32.0
该指标主要从专利申请的著录信息、法律事件等内容中挖掘其技术价值,专利类型、独立权利要求数量、无效请求次数等内容均可反映出专利的技术性价值。 技术创新是专利申请的核心,若您需要进行技术借鉴或寻找可合作的项目,推荐您重点关注该指标。
部分指标包括:
授权周期(发明)
29 个月独立权利要求数量
2 个从属权利要求数量
1 个说明书页数
11 页实施例个数
5 个发明人数量
5 个被引用次数
0 次引用文献数量
0 个优先权个数
0 个技术分类数量
4 个无效请求次数
0 个分案子案个数
0 个同族专利数
0 个专利获奖情况
无保密专利的解密
否经济价值 6.0
该指标主要指示了专利技术在商品化、产业化及市场化过程中可能带来的预期利益。 专利技术只有转化成生产力才能体现其经济价值,专利技术的许可、转让、质押次数等指标均是其经济价值的表征。 因此,若您希望找到行业内的运用广泛的热点专利技术及侵权诉讼中的涉案专利,推荐您重点关注该指标。
部分指标包括:
申请人数量
1申请人类型
机关团体许可备案
0 次权利质押
0 次权利转移
0 个海关备案
否法律价值 16.0
该指标主要从专利权的稳定性角度评议其价值。专利权是一种垄断权,但其在法律保护的期间和范围内才有效。 专利权的存续时间、当前的法律状态可反映出其法律价值。故而,若您准备找寻权属稳定且专利权人非常重视的专利技术,推荐您关注该指标。
部分指标包括:
存活期/维持时间
7法律状态
无权-未缴年费


















 苏公网安备 32041202001399号
苏公网安备 32041202001399号



 loading...
loading...